Pressmeddelande
Nya data presenterade från Oncopeptides pivotala fas 2-studie HORIZON med melflufen i RRMM-patienter vid det 24:e europeiska hematologimötet (EHA)
Presentation från EHA kommer att finnas tillgänglig på företagets hemsida under:
www.oncopeptides.com / Investors & Media / Presentationer / 2019 EHA
VD Jakob Lindberg kommenterar
”HORIZON är en studie som adresserar patienter med multipelt myelom i mycket sen fas. En majoritet av patienterna har metastaserad cancer (extramedullära tumörer, EMD) samt cytogenetisk högriskdisposition. Relapserade EMD-patienter är en särskilt svårbehandlad patientgrupp som svarar dåligt på behandling i kliniska prövningar, även under de senaste åren då nya moderna terapier kommit fram. Givet hur allvarligt sjuka patienterna i HORIZON är så är en tumörsvarsfrekvens (ORR) på 28%i kombination med en hanterbar biverkningsprofil mycket lovande och indikerar att melflufen plus dexametason kan komma att erbjuda även dessa patienter ett rimligt behandlingsalternativ. Dessa data kommer att utgöra grunden för vår registreringsansökan, om villkorat marknadsgodkännande (accelerated approval) för behandling av patienter med trippelklassrefraktärt multipelt myelom som vi nu har börjat förbereda”, säger Jakob Lindberg, VD för Oncopeptides.
Sammanfattande slutsatser från HORIZON-presentationen:
- Vid tidpunkten för datainsamling, den 6 maj, var 35 av de 121 av patienterna inkluderande fortsatt på behandling.
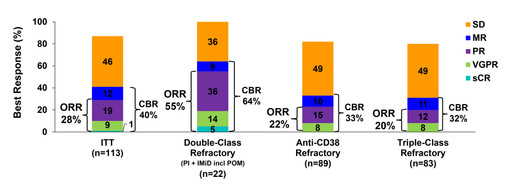
- Den totala responsen (ORR) var 28% med en Clinical Benefit Rate (CBR) om 40%, 36% av patienterna hade behandlats med 3 eller fler behandlingsregimer under de senaste 12 månaderna.
- Patienter med metastaserad cancer (extramedullära tumörer, EMD) hade en ORR på 29%.
- Majoriteten av patienterna, 86%, uppnådde sjukdomsstabilisering (SD eller bättre),
- Mediantiden för progressionsfri överlevnad (PFS) var 4 månader i den pågående studien.
- Behandlingen tolererades väl med huvudsakligen hanterbara hematologiska biverkningar, förekomsten av icke-hematologiska biverkningar var låg likaså andelen patienter som avbröt behandling på grund av biverkningar.
Professor Paul G Richardson kommenterar
”Antalet patienter med resistent myelom som karaktäriseras av metastaserad cancer (extramedullära tumörer EMD) och cytogenetisk högriskdisposition ökar trots de senaste framstegen. Det finns ett verkligt behov av ytterligare behandlingsalternativ baserat på nya verkningsmekanismer. Melflufen fortsätter att visa lovande aktivitet och hanterbar biverkningsprofil hos relapsande och refraktära patienter, i synnerhet bland trippelklassrefraktära patienter”, säger Paul Richardson MD, RJ Corman professor i medicin vid Harvard Medical School och direktör för klinisk forskning vid Jerome Lipper Multiple Myeloma Center, Dana-Farber Cancer Institute , Boston, USA.
Om OP-106 HORIZON-studien
Patientrekryteringen till studien fortskrider. Interimsresultaten som presenterats på EHA baseras på en datainsamling daterad den 6 maj 2019, då 121 patienter behandlats. 108 av dessa patienter hade erhållit två eller fler behandlingscykler. Målsättningen är att inkludera 150 patienter i studien. Patienterna i studien är resistenta mot pomalidomid och / eller daratumumab efter att de slutat svara på immunmodulerande läkemedel (IMiDer) och proteasomhämmare (PIs).
Mera information finns under: https://clinicaltrials.gov/ct2/show/NCT02963493?term=melflufen&rank=2
Sammanfattning av interimsdata för OP-106 HORIZON
Studien fortsätter att utvecklas positivt i denna kraftigt förbehandlade patientgrupp. Melflufen fortsätter att visa lovande effekt hos de patienter som slutat svara på lenalidomid- och PI-baserade behandlingar och därefter blivit resistenta mot räddningsbehandlingar baserade på daratumumab och / eller pomalidomid.
Medianåldern var 64 år, 62% av patienterna i studien hade en cytogenetisk högriskdisposition, 29% av patienterna klassificerades i ISS-stadie III och 60 av patienterna hade metastaserad cancer (extramedullära tumörer, EMD). Medianantalet tidigare behandlingslinjer var fem och mediantiden sedan diagnos var 6,2 år.Samtliga patienter i studien var bedömda av behandlande läkare som icke-responsiva eller icke-toleranta mot IMiDer och PIs. 91% av patienterna var dubbelklassrefraktära (IMiD + PI) och 79% var anti-CD38-refraktära. 74 % av patienterna var trippelklassrefraktära (IMiD+PI+Anti-CD38) och 59% var refraktära mot alkylerare. 98% av patientern var refraktära i sista behandlingslinjen.
Effekt
Interimsanalysen av effektdata visar en på en total respons (ORR) på 28% och att 86% av patienterna uppnådde sjukdomsstabilisering (SD eller bättre), se nedanstående tabell.
8 pts did not have available response information at data cutoff; 2 pts response evaluable, PI exposed, but refractoriness to PI subject to confirmation, so excluded from subgroup analysis
One pt with sCR also confirmed as MRD negative (10-6 sensitivity), with ongoing progression-free period of 13.6 mos
Median time to response 1.2 mos
CBR, clinical benefit rate; CR, complete response; MR, minimal response; ORR, overall response rate;
PD, progressive disease; PR, partial response; sCR, stringent CR; SD, stable disease; VGPR, very good PR.
För patienter med metastaserad cancer (EMD) var den totala responsen (ORR) 29%, se tabell nedan.

Säkerhet och tolerabilitet
Vid tidpunkten för datainsamling hade behandlingsrelaterade allvarliga biverkningar inträffat hos 20% av patienterna, oftast febril neutropeni (5%) och trombocytopeni (2%). Den totala förekomsten av icke-hematologiska biverkningar var låg. Andelen patienter som avbröt behandlingen på grund av biverkningar var 20%. Inga behandlingsrelaterade dödsfall inträffade. Sex patienter (6%) fick behandlingsrelaterade blödningar: fyra patienter av grad 1, två patienter av grad 3.
För ytterligare information kontakta:
Jakob Lindberg, VD för Oncopeptides
E-post: jakob.lindberg@oncopeptides.com
Telefon: +46 (0) 8 615 20 40
Rein Piir, chef för Investor Relations vid Oncopeptides
E-post: rein.piir@oncopeptides.com
Mobiltelefon: +46 (0) 70 853 72 92
Denna information är sådan information som Oncopeptides är skyldigt att offentliggöra enligt EU:s marknadsmissbruksförordning. Informationen lämnades, genom ovanstående kontaktpersons försorg, för offentliggörande den 16 juni 2019 kl.08.45.
Om melflufen
Melflufen är en lipofil peptidlänkad alkylerare som snabbt resulterar i en kraftig ansamling av cytotoxiska metaboliter i myelomceller genom peptidasaktivitet. Melflufen tillhör den nya klassen Peptidase Enhanced Cytotoxics (PEnCs), en familj lipofila peptider som verkar genom att de blir kluvna av peptidaser och som har potential att kunna behandla flera olika cancertyper. Peptidaser spelar en viktig roll i proteinhomeostasen och i cellulära processer som cellcykelprogression och programmerad celldöd. Melflufen tas snabbt upp av myelomceller genom dess höga lipofilicitet och klyvs omedelbart av peptidaser till en hydrofil alkylerare som blir fångad inuti myelomcellen. In vitro är melflufen 50 gånger mer potent i myelomceller jämfört med dess alkylerande metabolit beroende på peptidasaktiviteten och inducerar irreversibla skador på DNA samt programmerad celldöd. Melflufen har visat cytotoxisk aktivitet i myelomcellinjer resistenta mot andra behandlingar, inklusive alkylerare, och har i prekliniska studier även visats hämma DNA-reparation och angiogenes.
Om Oncopeptides
Oncopeptides är ett läkemedelsföretag med inriktning på utveckling av riktade terapier för svårbehandlade hematologiska cancerformer. Bolaget fokuserar på utvecklingen av produktkandidaten melflufen, en lipofil peptidlänkad alkylerare, tillhörande en ny läkemedelsklass kallad Peptidase Enhanced Cytotoxics (PEnC). Melflufen utvecklas som en ny behandling av den hematologiska cancersjukdomen multipelt myelom och testas för närvarande i en pivotal fas 2-studie kallad HORIZON och en bekräftande klinisk fas 3-studie kallad OCEAN där rekrytering pågår. Oncopeptides har huvudkontor i Stockholm och är noterat i Mid Cap-segmentet på Nasdaq Stockholm med kortnamn ONCO.
För mer information besök www.oncopeptides.com.